
При решении задач квантовой механики, связанных с атомами и молекулами, одним из важнейших аспектов является правильное указание квантовых чисел для описания состояния системы. В случае с атомами, функционирующими по модели Бора, существуют четкие правила для определения значений квантовых чисел, что позволяет точно предсказать энергетические уровни и другие характеристики атома. Для расчета таких величин важны принципы, заложенные в теории атомных орбиталь, а также параметры, определяющие распределение электронов.
Основные квантовые числа включают главное (n), орбитальное (l), магнитное (m) и спиновое (s) число. Главное квантовое число (n) определяет размер орбитали и энергетику уровня, на котором находится электрон. Орбитальное квантовое число (l) связано с формой орбитали, а магнитное квантовое число (m) характеризует ориентацию орбитали в пространстве. Спиновое квантовое число (s) определяет направление спина электрона, что имеет важное значение для различных взаимодействий.
Для правильного указания значений квантовых чисел для canon важно придерживаться строгих правил и учитывать принципы симметрии системы. Например, для элемента, имеющего несколько энергетических уровней, значения n, l и m должны соответствовать конкретным уровням и подуровням, заданным в таблице Менделеева. Прежде чем указывать числа, необходимо точно определить, к какой подгруппе элемента или иона относится исследуемый атом, что поможет корректно расставить все квантовые числа.
Важно помнить, что для корректного расчета необходимо учитывать взаимодействие между электронами, а также возможные квантовые эффекты, такие как спин-орбитальное взаимодействие. Такие эффекты могут влиять на распределение энергии и требуют дополнительной корректировки числовых значений.
Основные квантовые числа: что нужно знать для работы с canon

В контексте работы с canon важно понимать, как правильно указывать квантовые числа для различных электронных состояний. Квантовые числа определяют состояние электрона в атоме и влияют на его энергию и поведение в атомных и молекулярных системах. Рассмотрим основные из них.
Главное квантовое число (n) отвечает за размер орбитали и её энергию. Оно всегда принимает целые значения, начиная с 1. Чем больше значение n, тем выше энергия и более удалена орбиталь от ядра. При работе с canon правильный выбор этого числа важен для точного моделирования энергетических уровней атомов и молекул.
Квантовое число орбитального момента (l) определяет форму орбитали и также влияет на энергию электрона. Для каждого значения n существуют ограничения для l: оно может принимать значения от 0 до n-1. Например, для n = 3 возможные значения l – 0, 1 и 2. Для работы с canon важно учитывать правильное соотношение этих чисел, чтобы корректно описать геометрию молекул и их поведение.
Магнитное квантовое число (ml) определяет ориентацию орбитали в пространстве. Оно может принимать значения от -l до +l, включая 0. Например, для l = 1 значения ml могут быть -1, 0 и +1. При расчётах для canon важно учесть, как изменяется ориентация орбитали, поскольку это влияет на взаимодействия между частицами и молекулами.
Спиновые квантовые числа (ms) определяют направление спина электрона. Это число может быть либо +1/2, либо -1/2. Спин играет ключевую роль в описании магнитных свойств вещества, и его точное указание важно для моделирования взаимодействий в canon. Он влияет на множество факторов, включая экранирование и взаимодействие между электронами в молекуле.
При работе с canon важно правильно комбинировать эти квантовые числа для точного моделирования электронных состояний и взаимодействий в атомах и молекулах. Неправильное указание квантовых чисел может привести к искажению результатов и потере точности в расчётах.
Как задать главное квантовое число для атомных орбит
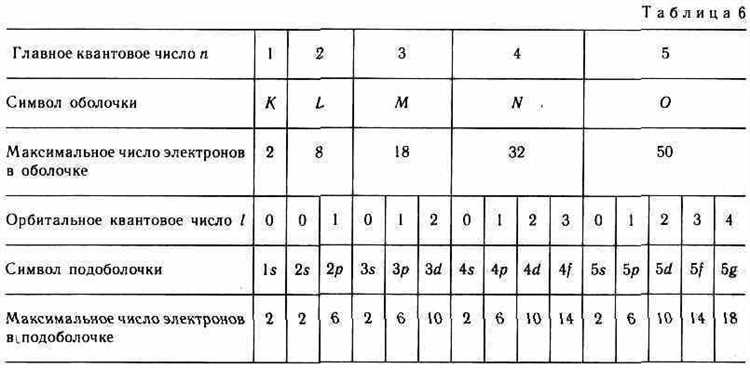
Главное квантовое число (n) определяет энергетический уровень атома и связан с размером орбитали. Для каждого атома существует определённый диапазон значений этого числа. Оно принимает целочисленные значения от 1 до бесконечности, где 1 соответствует наименьшему энергетическому уровню, а большие значения – более удалённым и высокоэнергетическим орбитам.
Для корректной настройки значения n необходимо учитывать несколько факторов, в том числе:
- Тип атома: для каждого элемента в периодической системе значение n зависит от его положения. Например, водород имеет уровень 1 для основного состояния.
- Период элемента: элементы одной группы в таблице Менделеева имеют схожие значения n для внешних электронов.
- Энергетическое состояние атома: значение n для возбужденных состояний атома будет выше, чем для основного.
При вычислении главного квантового числа для атомных орбит можно воспользоваться принципами квантовой механики. Число n связано с радиусом орбитали, а также с её энергией. Чем выше значение n, тем выше энергия электрона, и тем больше радиус его орбитали.
Важно помнить, что хотя главное квантовое число n определяет энергетический уровень, оно не даёт информации о типе орбитали. Для этого используются другие квантовые числа, такие как азимутальное (l), магнитное (m) и спиновое (s). Тем не менее, правильный выбор значения n является основой для правильного моделирования атомных орбит.
Принципы определения орбитального квантового числа в canon
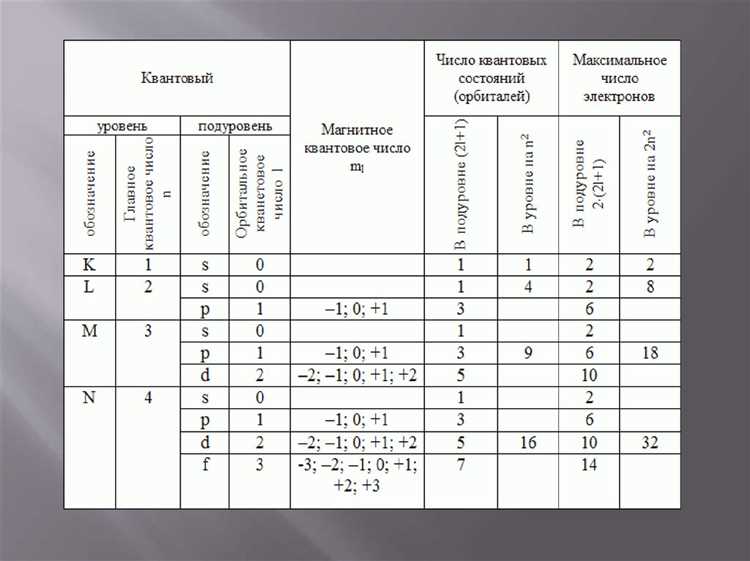
Орбитальное квантовое число (l) в квантовой механике описывает форму орбитали электрона в атоме. В контексте работы с системами канонического описания (canon) оно играет ключевую роль в определении энергетического состояния и распределения вероятности нахождения электрона в различных точках пространства.
Основной принцип определения орбитального квантового числа заключается в его связи с главным квантовым числом (n) и отношением к угловому моменту системы. Для канонического описания, где важна точность и минимизация погрешностей, нужно учитывать несколько факторов:
- Связь с главным квантовым числом (n): Орбитальное квантовое число l принимает значения от 0 до n-1. Например, для атома водорода с n=3, возможные значения l: 0, 1, 2.
- Энергетическая область: В зависимости от значения l, энергия электрона будет изменяться, что влияет на вероятность нахождения его на разных орбитах. В canon важно правильно учитывать эти зависимости для точных расчетов.
- Угловой момент: Орбитальное квантовое число связано с величиной углового момента электрона, выражаемого через планковую постоянную. Это ключевой параметр при решении дифференциальных уравнений в контексте канонического описания.
Важно учитывать, что в канонических системах, где используется высокоточное моделирование, определение l может зависеть от дополнительных факторов, таких как внешние поля или взаимодействия частиц, что может изменять традиционную зависимость от n.
- Влияние магнитного поля: Если система взаимодействует с магнитным полем, то орбитальное квантовое число может быть дополнительно корректировано, что важно для расчета в системах, использующих canon.
- Релятивистские эффекты: Для высокоскоростных частиц необходимо учитывать релятивистские поправки, которые могут изменять значения l в зависимости от энергии системы.
Таким образом, в каноническом описании важно не только правильно выбрать диапазон возможных значений орбитального квантового числа, но и учесть все внешние факторы и взаимодействия, которые могут повлиять на его определение и точность расчетов.
Указание магнитного квантового числа для правильного моделирования
Рекомендации по указанию ml в моделировании:
1. Учет симметрии системы. Магнитное квантовое число влияет на симметрию системы. Важно точно указать ml в моделях с учетом симметрии, чтобы избежать ошибок в предсказаниях электронных распределений и энергетических уровней. Для точных расчетов следует использовать все возможные значения ml в зависимости от контекста задачи.
2. Корректная настройка внешнего магнитного поля. При моделировании с учетом внешнего магнитного поля магнитное квантовое число определяет, как будут распределяться уровни энергии атома. Неверное указание ml может привести к ошибочным результатам, особенно при учете эффекта Зеемана. Убедитесь, что параметры поля и квантовых чисел согласованы для правильного моделирования этих эффектов.
3. Применение в химических расчетах. При моделировании молекул в химии магнитное квантовое число играет ключевую роль в расчетах, связанных с молекулярными орбитами и их взаимным взаимодействием. При указании ml следует учитывать влияние на молекулярные орбитали и их ориентацию в пространстве. Это важно для точности расчетов электронных спектров.
4. Учет взаимосвязи с другими квантовыми числами. Важно помнить, что магнитное квантовое число связано с орбитальным квантовым числом и зависит от его величины. Ошибка в указании ml может нарушить согласованность всех квантовых чисел, что повлияет на точность моделирования в квантовой механике и молекулярной динамике.
Как правильно указать спиновые квантовые числа в программном обеспечении canon
В программном обеспечении Canon для работы с квантовыми числами спина важно точно указать значения, соответствующие конкретной системе. Спиновое квантовое число обычно обозначается как «s», и в программном контексте его значение указывается в виде целых чисел или полувеличин, в зависимости от типа частицы.
Для электронов, протонов и нейтронов спиновое квантовое число принимается равным 1/2. В таких случаях в программе можно использовать стандартное значение «s = 1/2». Важно помнить, что программа автоматически определяет другие параметры на основе этого значения, например, возможные значения проекций спина.
Для более сложных систем, например, для атомных орбит, спиновое квантовое число может быть указано в зависимости от взаимодействий между частицами. В таких случаях важно также задать возможные значения проекции спина на выбранную ось, что часто обозначается как «m_s». Например, для системы с «s = 1» возможные значения проекции могут быть -1, 0 и 1. Указание этого параметра поможет точно описать квантовые состояния системы в моделировании.
В случае, когда спиновые квантовые числа представлены для более сложных частиц (например, для атомных или молекулярных систем), программное обеспечение Canon предлагает дополнительные опции для задания этих чисел в виде пары чисел, где первое обозначает полный спин, а второе – проекцию. Например, для состояния с полным спином «S = 3/2» и проекцией «m_s = -3/2», в программе вводится следующая пара значений.
Точно указав спиновые квантовые числа в программном обеспечении, важно также учитывать тип взаимодействий, которые могут влиять на изменения этих чисел в процессе симуляции. Некоторые модели требуют явного указания симметрий системы и возможных изменений спиновых состояний, что необходимо учитывать при настройке параметров программного обеспечения.
Вопрос-ответ:
Что такое канонические квантовые числа и как их указать?
Канонические квантовые числа — это набор чисел, который описывает состояние электрона в атоме с учетом его энергетических уровней и орбитальных характеристик. К таким числам относятся: главное квантовое число (n), орбитальное квантовое число (l), магнитное квантовое число (m) и спиновое квантовое число (s). Чтобы правильно указать их, нужно сначала выбрать главное квантовое число, затем — орбитальное, которое зависит от первого, и дальше можно определить магнитное и спиновое числа, учитывая правила и ограничения для каждого из них.
Как выбрать главное квантовое число для канонических чисел?
Главное квантовое число (n) определяет основной энергетический уровень электрона. Оно может быть любым положительным целым числом: 1, 2, 3 и так далее. Чем выше значение n, тем дальше электрон от ядра, и тем выше его энергия. Для того чтобы указать это число, достаточно знать, на каком энергетическом уровне находится электрон. Например, если электрон на первом уровне, то n = 1, на втором — n = 2 и так далее.
Какое значение имеет орбитальное квантовое число (l) в контексте канонических чисел?
Орбитальное квантовое число (l) связано с формой орбитали электрона. Оно зависит от значения главного квантового числа n и может принимать значения от 0 до (n-1). Для каждого значения l существует своя обозначенная форма орбитали, например: для l = 0 — это s-орбиталь, для l = 1 — p-орбиталь, для l = 2 — d-орбиталь и так далее. Чтобы указать l, нужно учитывать главное квантовое число, так как оно задает возможные значения l. Например, если n = 3, то l может быть 0, 1 или 2.
Что такое магнитное квантовое число (m) и как оно определяется?
Магнитное квантовое число (m) характеризует ориентацию орбитали в пространстве относительно внешнего магнитного поля. Оно может принимать значения от -l до +l, включая 0. Например, если l = 1, то m может быть -1, 0 или +1. Для определения m нужно сначала точно знать значение орбитального квантового числа (l), так как это число определяет, сколько различных значений m может быть. Магнитное квантовое число влияет на пространственное распределение электрона.
Как указать спиновое квантовое число (s) для канонических квантовых чисел?
Спиновое квантовое число (s) связано с внутренним спином электрона, который может быть либо +1/2, либо -1/2. Это число не зависит от остальных квантовых чисел и указывается только для определения направления спина электрона. Спин — это важная характеристика, которая описывает вращение частицы, но в отличие от других квантовых чисел, оно может принимать только два значения. Для указания s нужно просто выбрать одно из этих значений в зависимости от направления спина.
Какие значения квантовых чисел нужно указать для канона в квантовой механике?
Для канона в квантовой механике нужно указать четыре квантовых числа: главное квантовое число (n), орбитальное квантовое число (l), магнитное квантовое число (m) и спин. Главное квантовое число (n) определяет энергию и размер орбитали, орбитальное квантовое число (l) — форму орбитали, магнитное квантовое число (m) указывает ориентацию орбитали в пространстве, а спин (s) — свойство электрона, отвечающее за его внутренний момент импульса. Эти значения должны быть согласованы между собой, чтобы соблюсти правила квантования.
Как правильно определить квантовые числа для атома, используя канон?
Для определения квантовых чисел атома необходимо учитывать несколько принципов. Главное квантовое число (n) задаёт энергетический уровень атома, где n может принимать целые значения от 1 до бесконечности. Орбитальное квантовое число (l) зависит от n и принимает значения от 0 до n-1, определяя форму орбитали. Магнитное квантовое число (m) связано с ориентацией орбитали и варьируется от -l до +l. Спин электрона обозначается числом s, которое может быть либо +1/2, либо -1/2. Правильное указание этих чисел позволяет точно описать электронные состояния атома в рамках канона квантовой механики.






